Câu 30 : Cho phản ứng: .
a) Biết năng lượng liên kết ở của và lần lượt là 159,436 và 569. Tính biến thiên enthalpy chuẩn của phản ứng.
b) Khi tạo thành 16 gam HF từ phản ứng trên thì lượng nhiệt tỏa ra hay thu vào là bao nhiêu?
Câu 30: Xét quá trình đốt cháy khí propane C3H8(g):
C3H8(g) + 5O2(g) 3CO2(g) + 4H2O(g)
a) Tính biến thiên enthalpy chuẩn của phản ứng dựa vào bảng nhiệt tạo thành của hợp chất và dựa vào dựa vào bảng năng lượng liên kết.
Biết nhiệt tạo thành của C3H8(g); CO2(g) và H2O(g) lần lượt là : 105,00; 393,50 và 241,82 kJ/mol.
Biết EC-H = 418 kJ/mol; EC-C = 346 kJ/mol; EO=O = 494 kJ/mol; EC=O = 732 kJ/mol và EO-H = 459 kJ/mol.
b) So sánh hai giá trị đó và nếu có sự khác biệt, hãy giải thích tại sao lại có sự khác biệt đó ?
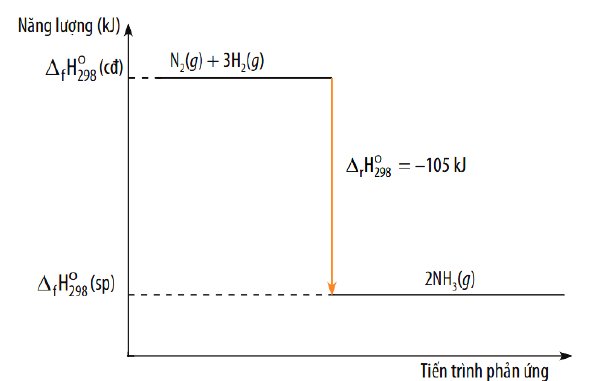
c) Tính biến thiên enthanpy của phản ứng tạo thành ammonia (sử dụng năng lượng liên kết).
Cho biết phản ứng thu nhiệt hay toả nhiệt và vẽ sơ đồ biểu diễn biến thiên enthalpy của phản
ứng 3H2 (g) + N2 (g) → 2NH3 (g)
Liên kết Eb (kJ/ mol)
H – N 386
H – H 436
N ≡ N 945
\(\Delta_rH^{^{ }o}_{298}=3\cdot436+945-2\left(3\cdot386\right)=-63kJ\cdot mol^{-1}\)
Sơ đồ:
d) Cho biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945
kJ/mol và 607 kJ/mol. Biến thiên enthalpy chuẩn của phản ứng dưới đây bằng bao nhiêu?
N2(g) + O2(g) 2NO(g)
A. -832 kJ. B. +832 kJ. C. -225 kJ. D. +225 kJ.
\(\Delta_rH^{^o}_{298}=945+494-2\cdot607=+225kJ\\ \Rightarrow D\)
Tra cứu các giá trị năng lượng liên kết ở phụ lục 2
a) Hãy tính biến thiên enthalpy chuẩn ∆rH0298 của 2 phản ứng dưới đây:
F2(g) + H2(g) → 2HF (g)
O2(g) + 2H2(g) → 2H2O(g)
b) Ở hai phản ứng trên, fluorine và oxygen đều đóng vai trò là chất oxi hóa. Dựa vào giá trị ∆rH0298, cho biết phản ứng oxi hóa – khử nào thuận lợi hơn.
a)
- Xét phản ứng: F2(g) + H2(g) → 2HF (g)
+ Ta có: ∆rH0298 = Eb(F2) + Eb(H2) – 2xEb(HF) = 159 + 436 – 2x565 = -535 (kJ/mol)
- Xét phản ứng: O2(g) + 2H2(g) → 2H2O(g)
+ Ta có: ∆rH0298 = Eb(O2) + 2xEb(H2) – 2x2xEb(OH) = 142 + 2x436 – 2x2x464 = -842 (kJ/mol)
b)
Giá trị biến thiên enthalpy của phản ứng (2) âm hơn giá trị biến thiên enthalpy của phản ứng (1)
=> Phản ứng oxi hóa – khử (2) diễn ra thuận lợi hơn
a) Phương trình F2(g) + H2(g) → 2HF(g)
Δ𝑟𝐻0298 = -535 kJ
Phương trình: O2(g) + 2H2(g) → 2H2O (g)
Δ𝑟𝐻0298 = -842 kJ
b ) Phản ứng của oxygen thuận lợi hơn
a) Xác định biến thiên enthalpy của phản ứng sau ở điều kiện chuẩn:
4FeS2 (s) + 11O2 (g) → 2Fe2O3 (s) + 8SO2 (g)
Biết nhiệt tạo thành ΔrH0298 của các chất FeS2(s), Fe2O3(s) và SO2(g) lần lượt là -177,9 kJ/mol,
-825,5 kJ/mol và -296,8 kJ/mol.
\(\Delta_rH^o_{298}=2\left(-825,5\right)+8\left(-296,8\right)-4\left(-177,9\right)\\ \Delta_rH^o_{298}=-3313,8\left(kJ\right)\)
Quá trình lên men rượu vang xảy ra phản ứng hóa học sau
C6H12O6(s) ----> 2C2H5OH(1)+2CO2(g)
a. Tính biến thiên enthalpy chuẩn của phản ứng theo nhiệt tạo thành chuẩn của các chất (biết nhiệt tạo thành chuẩn của C6H12O6(s) C2H5OH(l); CO2(g) có giá trị lần lượt là –1274kJ/mol: 277,69 kJ/mol 393,51kJ/mol
b, Tính lượng nhiệt tòa ra hay thu vào khi lên men 3 kg nhỏ (chứa khoảng 7% đường glucose) ở điều kiện chuẩn
Cho biết phản ứng tạo thành 2 mol HCl(g) ở điều kiện chuẩn sau đây tỏa ra 184,6 kJ:
H2(g) + Cl2(g) → 2HCl(g) (*)
Những phát biểu sau dưới đây là đúng?
A. Nhiệt tạo thành của HCl là -184,6 kJ.mol-1.
B. Biến thiên enthalpy phản ứng (*) là -184,6 kJ.
C. Nhiệt tạo thành của HCl là -92,3 kJ.mol-1.
D. Biến thiên enthalpy phản ứng (*) là -92,3 kJ.
A. Sai vì đó là nhiệt tạo thành của 2 mol HCl
B. Đúng vì (*) là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm
C. Đúng vì nhiệt tạo thành tỉ lệ với số mol chất tạo thành, đây là phản ứng tỏa nhiệt nên mang giá trị âm
D. Sai vì phản ứng (*) ứng với 2 mol
=> Đáp án B, C đúng
Cho phản ứng sau ở điều kiện chuẩn:
H-H(g) + F-F(g) -> 2H-F(g)
Tính năng lượng cần để phá vỡ các liên kết trong H2, F2 và năng lượng tỏa ra (theo kJ) khi hình thành liên kết trong HF cho phản ứng trên.
∆r\(H^o_{298}\) = EH-H + EF-F – 2.FH-F
∆r\(H^o_{298}\) = 436 + 159 – 2.565 = -535 kJ
Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l), giải phóng 49,98 kJ. Tính biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2.
nC2H2 = 1/26 (mol)
Đốt cháy 1/26 mol C2H2 tỏa ra 49,98 kJ
=> Đốt cháy 1 mol C2H2 tỏa ra x kJ
=> x = 1 x 49,98 : (1/26) = 1299,48 kJ
=> ${\Delta _r}H_{298}^0$ = -1299,48 kJ (vì đây là phản ứng tỏa nhiệt nên enthalpy mang giá trị âm)